Views: 17
Ann Zeuner, Maria Laura De Angelis, Rachele Rossi e Federica Francescangeli
Dipartimento di Oncologia e Medicina Molecolare, ISS
Secondo una leggenda popolare cinese ogni persona porta fin dalla nascita un invisibile filo rosso legato al mignolo della mano sinistra, che lo lega alla propria anima gemella. Allo stesso modo, la ricerca è collegata attraverso un filo immaginario alla possibilità di migliorare la vita dei pazienti sia a livello individuale che a livello collettivo. I fili rossi che collegano la ricerca alla salute dei cittadini sono numerosi, ma in questo articolo ne seguiremo uno in particolare, rappresentato da una peculiare popolazione di cellule tumorali denominate cellule staminali tumorali (CST). Identificate vent’anni fa nelle leucemie e successivamente in molti altri tumori, le CST sono cellule capaci di rigenerarsi indefinitamente, di sopravvivere alle terapie e di generare metastasi in altri distretti corporei (1). I laboratori di ricerca dell’Istituto Superiore di Sanità studiano le CST da circa quindici anni e hanno scoperto per la prima volta le cellule staminali nei tumori del colon-retto e del polmone, ampliando successivamente gli studi anche ad altri tumori (2, 3). Negli anni seguenti, l’Istituto ha ospitato una biobanca di CST di tumori intestinali e ha pubblicato numerosi studi sugli aspetti biologici e clinici di queste cellule, ponendosi all’avanguardia in quest’area di ricerca (4-7).
Le cellule staminali e le nuove sfide della ricerca sul cancro
La ricerca sulle CST ha avuto un momento di grande slancio alimentato dal concetto che l’eliminazione selettiva di queste cellule (considerate le madri di tutte le cellule tumorali) avrebbe portato all’estinzione del tumore stesso. Tuttavia, l’avanzamento delle conoscenze nel campo delle CST ha rivelato una realtà molto più complessa del previsto ed evidenziato i limiti sia delle ipotesi che dei modelli sperimentali inizialmente a disposizione degli scienziati. A ciò si è aggiunto il fatto che le sperimentazioni cliniche di agenti farmacologici “anti-staminali tumorali” hanno finora dato risultati piuttosto deludenti, sottolineando la necessità di sviluppare nuove teorie, modelli e approcci clinici in grado di affrontare più efficacemente la capacità rigenerativa dei tumori (8, 9). A questo proposito, negli anni più recenti è emerso che le CST non rappresentano un’entità statica, ma una condizione transitoria che può essere acquisita e persa più volte da cellule tumorali diverse (8, 10). Lo stato staminale di una cellula tumorale dipende in parte da fluttuazioni dell’espressione genica, che avvengono in modo casuale o stocastico. Ma è anche fortemente determinato da fattori (micro)ambientali come la disponibilità di ossigeno o sostanze nutritive, la vicinanza a particolari cellule di supporto (che formano la nicchia staminale), l’azione del sistema immunitario, la presenza di terapie antitumorali o di altre sostanze capaci di influenzare la crescita tumorale (11). Una delle caratteristiche fondamentali delle CST è una estrema diversificazione delle strategie di sopravvivenza, unita a una grande adattabilità. Infatti all’interno di un singolo tumore le CST, a dispetto del fatto di avere lo stesso profilo genetico, si trovano in stati funzionali molto diversi. Gli stati alternativi in cui si possono trovare le CST includono proliferazione/ quiescenza, stato epiteliale o mesenchimale, metabolismo basato sulla glicolisi o sulla fosforilazione ossidativa, presenza/assenza di marcatori proteici. In realtà, anche il concetto di “stati alternativi” si sta progressivamente sgretolando di fronte all’osservazione che le CST non compiono uno switch tra uno stato e l’altro, ma occupano l’intera gamma di possibilità ibride tra una configurazione e il suo opposto, diversificando enormemente le possibilità di adattamento (8, 12). Non solo le CST si trovano in una molteplicità di stati che rendono difficile il loro riconoscimento e soprattutto il targeting farmacologico, ma sono in grado di rispondere prontamente a qualsiasi variazione ambientale grazie a una maggiore plasticità rispetto alle cellule tumorali non-staminali. In risposta a nuove condizioni ambientali le CST modificano velocemente il loro assetto molecolare attraverso modificazioni epigenetiche che comprendono l’adattamento metabolico e la modulazione di sequenze regolatorie non codificanti (microRNA, piRNA, long-noncoding RNA, elementi trasponibili). La capacità delle CST di rispondere a cambiamenti ambientali con variazioni epigenetiche (e solo in un secondo tempo con mutazioni genetiche, che possono insorgere per esempio in seguito a una esposizione prolungata a un farmaco) rende queste cellule estremamente versatili e pronte a fronteggiare le aggressioni esterne in tempi rapidissimi (8, 13).
Cellule staminali tumorali quiescenti: il nemico silenzioso
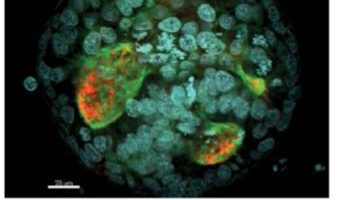
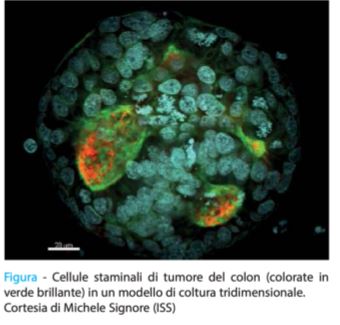
Fra le strategie di sopravvivenza messe in atto dalle CST, una delle più efficaci è la quiescenza o dormienza. Si tratta di uno stato in cui la cellula non si divide attivamente, ma riduce le attività relative alla proliferazione e alla biosintesi e adotta una strategia metabolica che le permette di sopravvivere in presenza di quantità limitate di ossigeno e di sostanze nutritive. Allo stesso tempo, la cellula staminale quiescente incrementa le sue capacità difensive, aumentando l’espressione di fattori di sopravvivenza che la proteggono da aggressioni esterne. Le CST quiescenti risultano estremamente utili alla sopravvivenza del tumore, e infatti si ritrovano in tutte le fasi principali della malattia (8). In primo luogo le CST quiescenti si trovano nei tumori primari: negli anni addietro sono state identificate nei tumori della mammella, del pancreas e dell’ovaio, nel glioblastoma e nel melanoma (8). Recentemente il nostro team ha rivelato l’esistenza di CST quiescenti nel tumore del colon-retto, riuscendo per la prima volta a caratterizzare i segnali intracellulari attivi all’interno di queste cellule e i principali fattori responsabili della loro sopravvivenza (vedi Figura) (14). Le CST quiescenti presenti nei tumori primari hanno la capacità di sopravvivere alle terapie antitumorali e riformare un tumore nello stesso luogo anche a distanza di molti anni.
Uno dei problemi più rilevanti collegati alle CST è rappresentato dalla loro capacità migratoria, grazie alla quale possono staccarsi attivamente dal tumore, entrare nel circolo sanguigno e stabilirsi in altri distretti corporei adatti allo sviluppo di metastasi. Una volta giunte nei siti pre-metastatici le CST creano una nicchia adatta a soddisfare i loro bisogni, sfruttando le proprietà delle cellule locali e talvolta usurpando la nicchia delle staminali appartenenti al tessuto stesso. Le CST insediate nei siti pre-metastatici rimangono per un periodo di lunghezza variabile nello stato quiescente, che le rende più resistenti e le aiuta a eludere le difese immunitarie (8, 15).
CST quiescenti e recidive tumorali: nuovi concetti di prevenzione e implicazioni per la salute pubblica
L’esistenza di CST quiescenti, che possono rimanere nascoste in vari organi o tessuti anche dopo la rimozione chirurgica del tumore, ha importanti implicazioni per i ricercatori, per i medici e soprattutto per i pazienti che vivono dopo una diagnosi di cancro. Questi ultimi sono aumentati da 2 milioni e 244 mila nel 2006 a quasi 3 milioni e mezzo nel 2019 e rappresentano il 5,3% dell’intera popolazione italiana (16). È quindi evidente la necessità di comprendere a fondo i meccanismi che regolano la quiescenza delle CST e di sviluppare nuove strategie per prevenirne la riattivazione e la conseguente formazione di metastasi. Le strategie che potrebbero essere messe in atto per diminuire il rischio di recidiva nei pazienti sopravvissuti a un tum ore sono strettamente collegate alla conoscenza delle CST quiescenti e alla possibilità di interferire con i loro processi vitali. Una strategia terapeutica è rappresentata da farmaci in grado di eliminare direttamente le CST quiescenti o di prolungare lo stato di quiescenza. Alcune terapie antitumorali attualmente in uso si basano su questo principio, come la terapia ormonale utilizzata per i tumori ormono-sensibili del seno o della prostata. Altri farmaci in grado di prolungare la quiescenza delle CST sono in fase di sperimentazione pre-clinica o clinica (8, 13). La capacità delle CST di riattivarsi e di dar luogo a recidive sembra collegata anche a fattori relativi allo stile di vita, che influenzano fortemente la qualità del microambiente tumorale in termini di ossigenazione, acidità, presenza di stimoli infiammatori e accessibilità da parte delle cellule immunitarie. Un’alimentazione sana e naturale insieme ad attività fisica e riduzione dello stress hanno dimostrato di ridurre l’incidenza di recidive nel tumore della mammella (7). Nei tumori intestinali è stato dimostrato che le CST sono particolarmente sensibili alle sostanze presenti negli alimenti, e pertanto l’alimentazione può influire significativamente sulla comparsa della malattia, sulla progressione e sulla risposta alle terapie (17). Le nuove scoperte nel campo delle CST pongono nuove sfide alla ricerca e terapia dei tumori, ma anche alla sanità pubblica. Il concetto di prevenzione dei tumori si estende dalla necessità di evitare la malattia alla necessità di convivere con essa, ma allo stesso tempo di impedire che si manifesti in modo letale. Alcuni dei tumori più diffusi tra la popolazione come il cancro della prostata o della mammella possono rimanere silenti per decenni, nel corso dei quali è probabilmente possibile mettere in atto strategie preventive adatte a prolungare la dormienza della malattia. Un obiettivo primario della ricerca sanitaria è pertanto quello di identificare nuove strategie di prevenzione specificamente adatte a impedire la ricomparsa della malattia. Mantenere vivo il filo rosso che collega chi studia la malattia, chi la cura e chi la vive è fondamentale per realizzare questo obiettivo.
Riferimenti bibliografici
1. Kreso A, Dick JE. Evolution of the cancer stem cell model. Cell Stem Cell 2014;14(3):275-91.
2. Ricci-Vitiani L, Lombardi DG, Pilozzi E, et al. Identification and expansion of human colon-cancer-initiating cells. Nature 2007;445(7123):111-5.
3. Eramo A, Lotti F, Sette G, et al. Identification and expansion of the tumorigenic lung cancer stem cell population. Cell Death Differ 2008;15(3):504-14.
4. Zeuner A, Todaro M, Stassi G, et al. Colorectal cancer stem cells: from the crypt to the clinic. Cell Stem Cell 2014;15(6):692-705.
5. De Angelis ML, Zeuner A, Policicchio E, et al. Cancer stem cell-based models of colorectal cancer reveal molecular determinants of therapy resistance. Stem Cells Transl Med 2016;5(4):511-23.
6. Francescangeli F, Contavalli P, De Angelis ML, et al. Dynamic regulation of the cancer stem cell compartment by Cripto-1 in colorectal cancer. Cell Death Differ 2015;22(10):1700-13.
7. Orienti I, Francescangeli F, De Angelis ML, et al. A new bioavailable fenretinide formulation with antiproliferative, antimetabolic, and cytotoxic effects on solid tumors. Cell Death Dis 2019;10(7):529.
8. De Angelis ML, Francescangeli F, La Torre F, et al. Stem cell plasticity and dormancy in the development of cancer therapy resistance. Front Oncol 2019; 9:626.
9. Annett S, Robson T. Targeting cancer stem cells in the clinic: Current status and perspectives. Pharmacol Ther 2018;187:13-30.
10. Hermann PC, Sainz B Jr. Pancreatic cancer stem cells: A state or an entity? Semin Cancer Biol 2018;53:223-23.
11. Prager BC, Xie Q, Bao S, et al. Cancer stem cells: the architects of the tumor ecosystem. Cell Stem Cell 2019;24(1):41- 53.
12. Kröger C, Afeyan A, Mraz J, et al. Acquisition of a hybrid E/M state is essential for tumorigenicity of basal breast cancer cells. Proc Natl Acad Sci USA 2019;116(15):7353-62.
13. De Angelis ML, Francescangeli F, Zeuner A. Breast cancer stem cells as drivers of tumor chemoresistance, dormancy and relapse: new challenges and therapeutic opportunities. Cancers (Basel) 2019;11(10).
14. Francescangeli F, Contavalli P, De Angelis ML, et al. A pre-existing population of ZEB2+ quiescent cells with stemness and mesenchymal features dictate chemoresistance in colorectal cancer. J Exp Clin Cancer Res 2020;39(1):2.
15. Adorno-Cruz V, Kibria G, Liu X, et al. Cancer stem cells: targeting the roots of cancer, seeds of metastasis, and sources of therapy resistance. Cancer Res 2015;75(6):924-9.
16. Rapporto AIOM, AIRTUM, PASSI d’Argento, SIAPEC-IAP. I numeri del cancro in Italia 2019 (www.aiom.it/wp-con tent/uploads/2019/09/2019_Numeri_Cancro-operatoriweb.pdf).
17. Francescangeli F, De Angelis ML, Zeuner A. Dietary factors in the control of gut homeostasis, intestinal stem cells, and colorectal cancer. Nutrients 2019;11(12).