Visits: 216
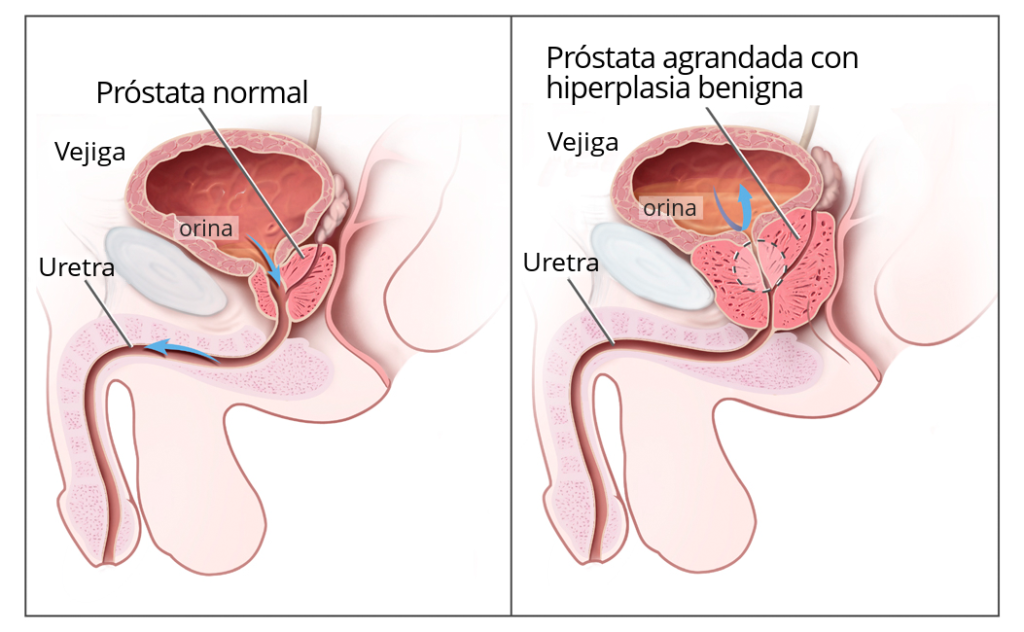
Astellas Pharma Inc. (TSE: 4503, Presidente e CEO: Kenji Yasukawa, Ph.D., “Astellas”) ha annunciato che il Comitato per i Medicinali per Uso umano (CHMP) dell’Agenzia Europea per i Medicinali (EMA) ha espresso parere positivo raccomandando un’indicazione aggiuntiva per la terapia orale enzalutamide per i pazienti con tumore della prostata sensibile agli ormoni (mHSPC, conosciuto anche come tumore della prostata metastatico sensibile alla castrazione o mCSPC). Gli uomini che ricevono una diagnosi di mHSPC tendono ad avere una prognosi sfavorevole, con una sopravvivenza mediana di circa 3-4 anni, una situazione che mette in evidenza la necessità di nuove opzioni di trattamento.
Se approvato dalla Commissione Europea, enzalutamide sarà l’unico trattamento orale approvato in Europa per la cura di tre tipi distinti di tumore della prostata avanzato: tumore della prostata non metastatico e metastatico resistente alla castrazione (CRPC) e tumore della prostata metastatico sensibile agli ormoni (mHSPC). La decisione del CHMP si basa sui dati del trial pivotale di Fase 3 ARCHES che ha valutato l’impiego di enzalutamide in uomini con mHSPC.
“Questo parere positivo del CHMP conferma il nostro costante impegno volto a dare risposte ai bisogni insoddisfatti degli uomini con tumore prostatico avanzato”, ha dichiarato Andrew Krivoshik, M.D., Ph.D., Senior Vice President and Global Therapeutic Area Head, Oncology Development, Astellas. “Siamo entusiasti all’idea di essere ancora più vicini all’approvazione di enzalutamide per il trattamento degli uomini affetti da tumore della prostata metastatico sensibile agli ormoni in Europa”.
I dati del trial ARCHES hanno dimostrato che enzalutamide in combinazione con terapia di deprivazione androgenica (ADT) riduce in modo significativo il rischio di progressione radiografica o morte del 61% vs. placebo in combinazione con ADT negli uomini con mHSPC (n=1.150; Hazard Ratio [HR]=0,39 [IC 95%: 0,30-0,50]; P<0,001).3
L’analisi di sicurezza del trial ARCHES sembra coerente con il profilo di sicurezza di enzalutamide dei precedenti trial clinici sul CRPC. Nel trial ARCHES, gli eventi avversi (AE) di Grado 3 o superiore (definiti come gravi/invalidanti o potenzialmente letali) sono stati simili per i pazienti che hanno ricevuto enzalutamide con ADT e quelli che hanno ricevuto placebo con ADT (24,3% vs. 25,6%).3
Il parere positivo del CHMP sarà ora valutato dalla Commissione Europea, autorità competente per l’approvazione di farmaci nei Paesi membri dell’Unione Europea e in Islanda, Norvegia e Liechtenstein.